腎盂尿管癌は、腎臓由来の腫瘍の10%、尿路上皮由来の腫瘍の5%程度と泌尿器科領域の癌の中でも頻度の高い癌ではない。[1]
泌尿器科領域の癌として頻度の高い癌である膀胱癌は診断、治療において内視鏡が重要である。大多数が経尿道的手術により治療され、10-30%が根治的膀胱全摘除術を要するが、内視鏡検査を一切受けない例は皆無である。
一方、腎盂尿管癌は同じく尿路上皮を発生母地とするにもかかわらず、内視鏡検査を受けずに根治的手術が施行されることが多い。この差異は、主として用いる内視鏡サイズによるものであるが、内視鏡器機は年々進歩している。尿管鏡検査をめぐる診断法、治療法の現況について解説する。
腎盂尿管癌の好発部位は、2/3が腎盂、残る1/3が尿管であり、尿管の中では下部尿管が大多数をしめる。腔内の多中心性発生傾向が強く、また膀胱癌を合併する例も20-50%をしめる。一方、両側性の頻度は4%と低い。このような病理学的特徴から、腎盂尿管癌に対する根治手術は、患側の腎尿管および尿管口を含む膀胱壁の部分切除である。腎の単純摘出にとどめた場合、33-75%に尿管断端再発が生ずる。根治手術後の生存率に関しては局所病期が重要な予測因子であり、Ta 100%、T1 91.7%、T2 72.6%、T3 40.5%と、周囲脂肪織に浸潤すると予後は不良である。一般に膀胱癌に比較して、腎盂尿管癌、特に尿管癌における浸潤癌の頻度は高く、予後も不良である。壁が薄いこと、診断に至るまでに時間を要することなどがその原因としてあげられる。
■画像検査、細胞診検査
従来の診断法ではどの程度の正診率か。AUA、EAUガイドラインで推奨されているのは、尿沈渣、尿細胞診、経静脈性排泄性尿路造影法(IVP)、膀胱鏡である。[2]
自排尿の細胞診検査の感度は29-50%と高くない。gradeにより大きな差があり、G3CISでは80-100%であるが、G1腫瘍では4%と低く、部位を特定できない。特異度は60-90%である。
IVPの感度は43-64%であり、その50-70%に陰影欠損、10-30%に尿路閉塞が見られる。凝血塊、X線透過性結石、線維上皮性ポリープ、内反乳頭腫、nephrogenic adenoma、上皮下過誤腫、血管圧排、嚢胞性尿管炎、結核症、子宮内膜症、アミロイドーシス、腸管ガス、腎乳頭壊死、真菌球などが鑑別すべき病態としてあげられる。これらの鑑別にはCTが必要であり、むしろ多列検出器CT(MDCT)が一般的になった現在はIVPの省略が可能である。
腎盂尿管癌に膀胱癌を合併する率は20-50%と高いことから、膀胱鏡は必須であり、尿細胞診の正診率を高めるためにも必要である。
これら一次検査で腎盂尿管癌の確診が得られぬ場合は二次検査が必要である。もっとも有用な検査はCTであり、造影MDCTの場合、感度は90-100%である。従来法のCTは5mm以下の小病変を見逃す可能性があったが、MDCTは検出可能である。尿路画像を構築する多列検出器コンピュータ断層尿路造影法(MDCTU)は小病変の検出に優れている。しかし、腎盂尿管の壁が薄いため、病期診断(浸潤癌)の感度はMDCTにおいても36-83%と高くない。特にT1とT2の診断は困難である。[3]
逆行性腎盂尿管造影(RP)は侵襲的検査であるが、75%以上の感度を有する。注入した泡が偽陽性所見となることがあるが、IVPで検出しにくい水腎症の原因病巣を描出することが可能である。同時に採取される尿管カテーテルからの分腎尿細胞診の感度は65-78%であるが、ブラシ擦過診では感度72-91%、特異度88-94%と正診率が向上する。膀胱癌を合併している場合、偽陽性をふせぐために上部尿路検査前にすべての膀胱癌を切除しておくことが必要である。しかし、膀胱CISを合併している場合は腫瘍細胞の混入が避けられない。
■尿管鏡検査
近年の報告では、尿管鏡検査の診断感度は85-90%とされている。1990年代後半、先端径6.8-7.5Fr以下の硬性鏡、軟性鏡が導入されてから、診断精度が改善した。細径内視鏡では、尿管口を拡張することなく、ガイドワイヤなしで直接内視鏡を尿管に進めることができる。診断の困難であった尿管内の小さな乳頭状腫瘍、CISのビロード状の粘膜の変化が検出可能である。軟性鏡の先端の曲り角度が上下ともに約180度と大きくなったことで、下腎杯もふくめすべての腎杯が十分に観察可能となった(図1)。光源器機、カメラビデオシステムの改良も大きく寄与していることはいうまでもない。硬性内視鏡では、先端にCCDカメラを装着し精細な画像が得られる器機が開発中である。
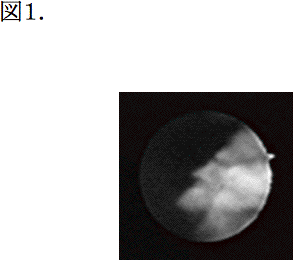
図1.7.5Fr軟性鏡による腎盂腫瘍像
現在われわれはLamらが述べている手順に従って検査を行っている。[4]
すなわち、7.5Fr硬性鏡を直接尿管口から下部尿管に進めて観察する。その際、病変をマスクせぬよう極力ガイドワイヤを用いない。上部あるいは中部尿管まで観察し、粘膜を3Frカップ型生検鉗子(ピラニア、Boston(R)で採取し、直接ホルマリン固定液中で回収する。生理的食塩水にて洗浄し回収細胞を細胞診に提出する。ガイドワイヤを尿管内に残し、軟性鏡に交換する。軟性鏡を前進させつつ、尿管と腎盂を観察する。希釈した造影を注入しすべての腎杯を観察する。異常を疑う病変をカップ生検鉗子、バスケット鉗子で採取する。生理食塩水にて洗浄し細胞診を提出する。狭窄性病変を認めず、検査が短時間で終了すれば、尿管ステントを留置する必要はないが、両側例、単腎例などで時間を要した場合は、数日間ステントを留置している。
しかし、尿管鏡生検標本は小さく、厳密な局所病期診断は困難である。生検でTaとされた腫瘍の45%は全摘標本でunderstagingであったと報告されている。病期診断には、内視鏡による形態所見と放射線画像所見、生検によって得られる腫瘍Gradeを加味して判断する必要がある。膀胱腫瘍と同様、肉眼的形態所見は腫瘍gradeによく相関し、71-80%でGradeが予測可能とされている。また、生検gradeと摘出検体のgradeは90%の例で一致すると報告されている。Gradeは局所病期の重要な予測因子であり、生検でのG1-2腫瘍は全摘標本で85%がpT1以下であったが、G3腫瘍では67%がpT2以上である。[5]
■尿管鏡検査の適応
尿管鏡検査は腎盂尿管癌の局在診断については高い感度を示すが、病期正診率は十分とはいえない。このような状況をふまえると、以下の2つが尿管鏡の適応と考えられる。
(1)局在診断と悪性の診断の不確実例
IVP、CTでの陽性所見、自排尿細胞診が陽性、膀胱に腫瘍を認めない、の3項目を満たさない例がこれに該当する。このような例では、われわれはRPをスキップして尿管鏡を施行している。画像診断が困難な良性の腫瘤性病変の鑑別診断が確実である。腎盂尿管CISの局在診断には内視鏡生検と部位別の洗浄細胞診が有用である。温存治療が可能なlow grade、low stage症例、腎盂尿管CISが含まれる可能性がある。
(2)内視鏡治療の適応がある例
(a)両側例、単腎例、腎機能障害例。60-74才の透析患者の5年生存率は49%とT2癌の予後よりも不良である。可能な例では温存が望ましい。
(b)内科的合併症のために根治的全摘除術施行が困難な症例。
(c)low grade、low stage症例。内視鏡治療の可否の判断には尿管鏡による局所病期診断が必須である。
一方、一次検査で腎盂尿管癌の局在診断が確実であり、臓器温存を考慮しなくてよい例では尿管鏡検査は不要である。遠隔転移、リンパ節転移が否定されれば、局所病期に関わらず根治術の適応である。合併症として、尿路穿孔、腫瘍播種、一過性の尿路閉塞がある。腎漏斗部は特に壁が薄く穿孔の危険性がある。腫瘍播種は稀とはいえ皆無ではないことから、不要な症例での尿管鏡検査は避けるべきである。当科における腎盂尿管癌治療のフローチャートを示す(図2)
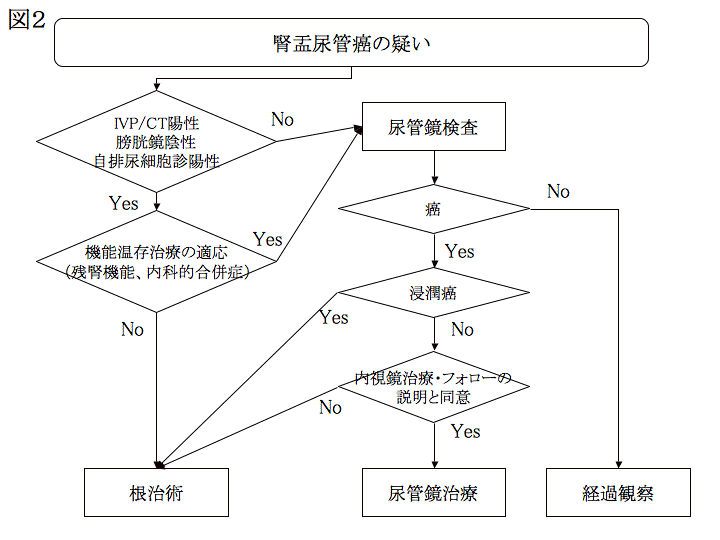
図2.腎盂尿管癌診断、尿管鏡治療フローチャート
■腎盂尿管鏡治療
腹腔鏡手術が癌治療の領域で普及しているが、本来の管腔を通して行う経尿道的内視鏡手術が侵襲、機能温存の2点において優っていることには異論がないであろう。これまでに報告された腎盂尿管鏡手術の治療成績は、再発率は高いが、比較的良好である(表1)。low grade、low stage、腫瘍径2cm以下が良い適応とされている。一方、G3腫瘍は予後不良であるが、根治術によってもやはり不良である。
経尿道的アプローチでは、7.5Fr尿管鏡とレーザー、バスケット鉗子の組み合わせ、あるいは電気切除対応11Fr尿管鏡が用いられる。合併症として尿管狭窄があるが、腫瘍の不完全切除か腫瘍再発が関わることが多い。腎盂腎杯の多発腫瘍、下腎杯の腫瘍は経皮的アプローチを要する。経皮的アプローチの利点は口径の大きい内視鏡と切除装置が使え、尿路変更術後も可能なことである。(図3)
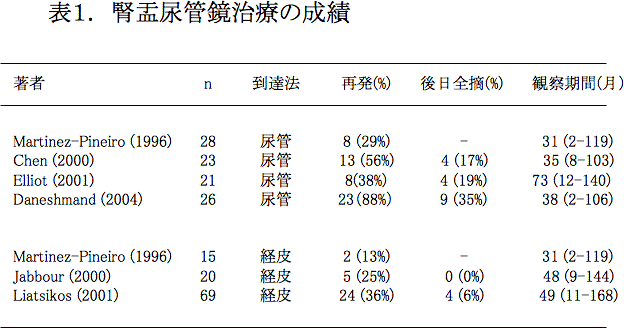
図3.経皮アプローチによる腫瘍切除術
腎不全(Cr3.3mg/dl)を合併した両側腎盂腫瘍症例(G2Ta)。一期的両側腎盂腫瘍切除術施行後、腎瘻からBCG注入8回施行。5年間再発なく、透析を回避して生存中。左:術前RP、右:術後腎瘻造影。
しかし、アクセス経路が造設できないことがあり、合併症として出血と隣接臓器損傷がある。また、晩期合併症として腎漏斗部狭窄が起こりうる。尿管鏡検査以上に腫瘍播種の危険が論じられるが、これまでの報告は稀である。(図4)
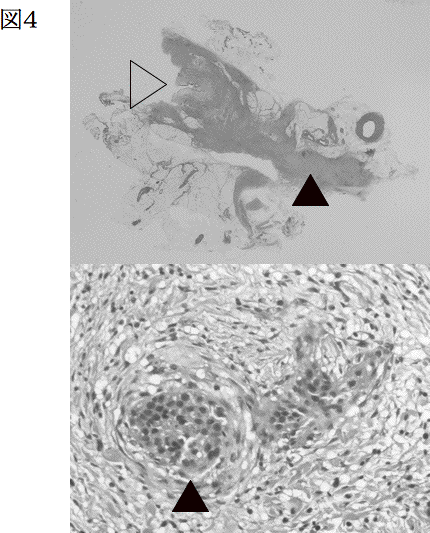
図4.腎盂尿管鏡切除術に伴う癌細胞播種
右腎盂癌(T3G3)根治術後の左腎盂癌。経皮的切除を2回施行するも切除しきれず、根治術施行(pT1G2)。上段:▽尿管。下段:腎盂周囲線維組織内に癌細胞(▲)を認める。(北大病院病理部久保田佳奈子博士提供)
内視鏡治療の問題は、局所再発に対する定期経過観察である。術後2-3年間、3-6月毎のIVP、RP、膀胱鏡が最低限必要とされているが、診断感度が高くないため、6月毎の尿管鏡検査が定期経過観察として推奨される。しかし、膀胱鏡検査よりも侵襲的な尿管鏡検査を長期間受け続けるのは十分な理解が必要である。内視鏡治療にあたってはこの点を十分に説明する必要があり、理解が得られない場合施行すべきではない。
■まとめ
腎盂尿管癌の診断には尿管鏡は必須ではない。しかし、悪性の診断、部位の診断が確定できない例、機能温存治療を考慮する例においては、尿管鏡を施行すべきである。尿管鏡治療は低侵襲であり、器機の進歩により手技の発展と適応の拡大が期待されるが、適応症例を十分吟味して施行されているのが現状である。
参考文献
[1] Flanigan RC. Urothelial tumors of the upper urinary tract. Campbell-Walsh Urology, Elevier, 1638-1652, (2007).
[2] Oosterlinck W, Solsona E, van der Meijden AP, et al. EAU guidelines on diagnosis and treatment of upper urinary tract transitional cell carcinoma.
Eur Urol. (2004);46(2):147-54.
[3] Anderson EM, Murphy R, Rennie ATM, et al. Multidetector computed tomography urography (MDCTU) for diagnosing urothelial malignancy.
Clin Radiol, (2007), 62, 324-332.
[4] Lam JS, Gupta M. Ureteroscopic management of upper tract transitional cell carcinoma. Urol Clin N Am 31 (2004), 115-128,
[5] Painter DJ, Timoney AG, Denton K, et al. The modern management of upper urinary tract urothelial cancer: tumour diagnosis, grading and staging. BJU Int, 99, 973-977, (2007).