治験の依頼について
▼治験の依頼について
 独立行政法人国立病院機構本部中央治験審査委員会 委員名簿
独立行政法人国立病院機構本部中央治験審査委員会 委員名簿![]() ※本部CRBをご利用される場合
※本部CRBをご利用される場合
新規試験ご依頼の流れについて
【施設情報】
● カルテ
 ソフトウエアサービス株式会社/Newtons2 e-カルテVer.2.2
ソフトウエアサービス株式会社/Newtons2 e-カルテVer.2.2
- ・厚労省 医療情報システムの安全管理に関するガイドラインに準拠
- ・データは原則永久保管
- ・ID・パスワードによる利用者管理・自動ログアウトあり
- ・全職員がトレーニング実施あり
- ・データが変更・消去された際の証跡機能あり
- ・バックアップは毎日実施
- ・ウイルスソフトの導入あり
- ・治験用に権限を限定したアカウントの発行は不可
 バリデーション文書あり
バリデーション文書あり
● 医療機器の点検、精度管理など
 精度管理について (2025.02改定)
精度管理について (2025.02改定)
● 検査値について
 臨床検査はISO15189認証を取得しております
臨床検査はISO15189認証を取得しております
※一覧に乗っていない項目についてはCRCにご相談ください
● 治験薬管理
● 透明性ガイドラインについて
 国立病院機構としては、個別に覚書の締結をしておりません。
国立病院機構としては、個別に覚書の締結をしておりません。
 必要がある場合は、以下のレターにてご対応下さい。
必要がある場合は、以下のレターにてご対応下さい。
▼【重要】電子カルテ閲覧に必要な手続き
【直接閲覧の前に】
カルテを閲覧いただく際は、治験主任まで下記資料のご提出をお願いいたします。
(同伴者についてもカルテを閲覧する場合は、誓約書を提出ください)
※ID/PASSの発行は1週間ほどかかり、当日ご来院時にお渡しとなります。
【直接閲覧の手順】
① CRCへ必要資料と日程の仮予約を依頼
② 仮予約完了後、直接閲覧票を事務局 SDV窓口 担当者へ提出して本予約依頼
③ 本予約確認後のお返事後、当日ご来院
※ご予約時の注意※
● 仮予約・本予約において、閲覧資料は下記テンプレートを使用してご依頼ください。
【準備希望 治験資料】
・治験審査委員会議事録(閲覧期間:****年**月〜****年**月IRB)
・必須文書ファイル(閲覧期間:****年**月〜****年**月)
・責任医師ファイル(閲覧期間:****年**月〜****年**月)
・別冊ファイル
(・依頼者版 責任医師ファイル(閲覧期間:****年**月〜****年**月))
・その他資料(治験薬ファイル、精度管理記録など 適宜追加)
・当院の議事録は紙資料のため、重複時は本予約の先着順となります。
・極力重複を避けるため、複数日程のご来院の際は議事録の閲覧日を予め最小日数で指定してください。
・「別冊ファイル」は契約書、各種ログ、同意書、FD、合意書、検査基準値を保管したファイルです。
・精度管理記録を閲覧時も「どの機械の」「いつ以降の記録か」明記してください。
・仮予約、本予約どちらの際もCCに副薬剤部長、主任、事務局を加えてください。
・ご来院の2週間前を目処にに本予約をお願いいたします。
● On-Site Monitoringに関する依頼者様およびCRA様へのお願い![]()
北海道がんセンター 対策レベル 現在2
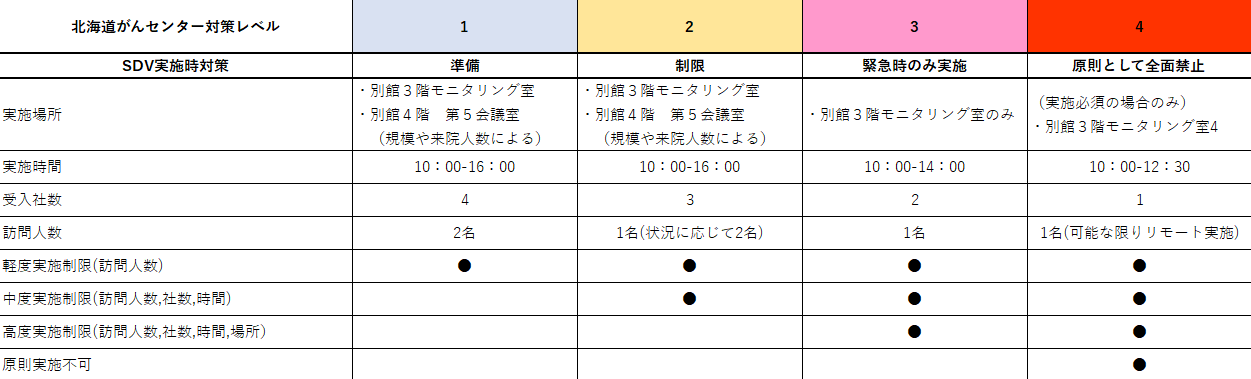
【遠隔閲覧について】
● 当院は遠隔カルテモニタリングが可能です。全試験へサーバー費用を固定費で契約いただきます。
 電子カルテの遠隔閲覧に関する業務手順書_北海道がんセンター1.0版
電子カルテの遠隔閲覧に関する業務手順書_北海道がんセンター1.0版 ![]()
① ID/PASSを申請してください(直接閲覧とは別アカウント、発行まで1〜2週間要します)
② 担当CRCと実施日の調整をお願いいたします。
③ 閲覧前に遠隔閲覧票をSDV窓口へご提出ください。
・閲覧は9:30-17:00で可能です
・申請した日時以外は患者情報へのアクセスはお控えください。(ログが残ります)
・被験者さまの遠隔閲覧の同意状況は担当CRCへ御確認ください。
● リモートカルテモニタリングの仕様は下記のとおりです。
閲覧可
・内服/注射処方内容
・検体検査のオーダーと結果
・カルテ記事
・レントゲン、CTの画像
・放射線レポート(F-Report)
・カルテに取り込まれているICFなどのPDF
閲覧不可
・心電図、エコー、肺機能検査の結果
・放射線治療計画
・内視鏡、病理、生理レポート
・Yagee文書(退院サマリなどを作成するカルテ付属ソフト)
・紙面のワークシートなど 電子カルテへの取り込みは行っておりません。
▼使用する書式について
◆使用する書式には統一書式と契約に関する書式があります。
企業主導・医師主導治験の統一書式は厚生労働省のサイトよりダウンロードしてください。 最新版をダウンロードして使用してください。
契約に関する書式は、書式名称をクリックしダウンロードしてください。
| 統一書式 | ||||
|---|---|---|---|---|
| 書式番号 | 書式名称 | 備考 | ||
| 書式1 | 履歴書 (治験責任医師・治験分担医師) | |||
| 書式2 | 治験分担医師・治験協力者リスト (新規・変更) | |||
| 書式3 | 治験依頼書 | 誤記防止のため、当院での追記は承っておりません。 | ||
| 書式4 | 治験審査依頼書 | |||
| 書式5 | 治験審査結果通知書 治験審査委員会委員出欠者リスト | |||
| 書式6 | 治験実施計画書等修正報告書 | 同意・説明文書のみの修正の場合は、責任医師(事務局代行)が作成いたします。 | ||
| 書式7 | 欠番 | |||
| 書式8 | 緊急の危険回避のための治験実施計画書からの逸脱に関する報告書 | |||
| 書式9 | 緊急の危険回避のための治験実施計画書からの逸脱に関する通知書 | |||
| 書式10 | 治験に関する変更申請書 | 分担医師の変更は、事務局にて取得。 ※同意・説明文書のみの変更であっても依頼者様にて作成のご協力をお願いしております。 |
||
| 書式11 | 治験実施状況報告書 | 責任医師が作成すべき書類ですが、依頼者様に作成のご協力をお願いしております。 | ||
| 書式12-1 | 重篤な有害事象に関する報告書 (医薬品治験) | |||
| 書式12-2 | 重篤な有害事象に関する報告書 (医薬品治験:詳細記載用) | |||
| 書式13-1 | 有害事象に関する報告書 (医薬品製造販売後臨床試験) | |||
| 書式13-2 | 有害事象に関する報告書 (医薬品製造販売後臨床試験:詳細記載用) | |||
| 書式14 | 重篤な有害事象及び不具合に関する報告書 (医療機器治験) | |||
| 書式15 | 有害事象及び不具合に関する報告書 (医療機器製造販売後臨床試験) | |||
| 書式16 | 安全性情報等に関する報告書 | 病院長と責任医師あてに2部ご提出ください。 | ||
| 書式17 | 治験終了(中止・中断)報告書 | |||
| 書式18 | 開発の中止等に関する報告書 | |||
| 参考書式1 | 治験に関する指示・決定通知書 | |||
| 参考書式2 | 直接閲覧実施連絡票 | ・備考欄にカルテ閲覧者を記載してください。 ・議事録を閲覧する場合は、閲覧希望のIRB期間を記載してください。 |
||
| 参考書式2-1 | 遠隔閲覧実施連絡票 | ・遠隔閲覧実施の日時確定後に治験担当窓口へ提出してください | ||
| 契約に関する書式(2020年4月契約分より使用) | ||||
| 様式1-1 | 受託研究(治験)契約書 (2社契約用) | 製本テープで綴じ、表面及び裏面に契印してください。 | ||
| 様式1-4 | 契約内容変更に関する覚書 (2社契約用) | 初回審議時に提出する覚書の場合、こちらの様式 |
||
| 別表 | ポイント算出表 | |||
